Il existe aujourd’hui près de 1000 fabricants de dispositifs médicaux rien qu’aux États-Unis. Ces entreprises gagnent de l’argent en mettant de nouveaux produits sur le marché. Mais avant de pouvoir vendre un nouveau type de pompe à insuline ou vulgariser la prochaine génération d’implants cochléaires, ils doivent prouver que leur dernière invention est sûre et efficace.
La preuve vient des études scientifiques réalisées par la recherche ; et la recherche médicale nécessite des sujets humains. Étudier des personnes sans leur accord total est illégal et contraire à l’éthique : les chercheurs doivent obligatoirement obtenir le consentement éclairé de leurs sujets avant de lancer ne serait-ce que la plus petite expérimentation. Ce consentement implique notamment d’informer le sujet sur les tenants et aboutissants de sa participation à l’étude. Cette association entre information et autorisation s’appelle le consentement éclairé.
Le consentement éclairé est un pilier de la recherche en médecine et dans bien des domaines. Si tous les projets de recherche qui impliquent des sujets humains nécessitent donc un consentement éclairé ; observer le pipeline de produits médicaux aux États-Unis nous permet d’analyser le consentement éclairé dans un écosystème commercial plus large. Regardons donc cela de plus près et voyons ce que nous pouvons apprendre sur le consentement éclairé dans la recherche.
Les principaux acteurs du processus de consentement éclairé pour la recherche sur les dispositifs médicaux
Un consentement éclairé est requis pour toute étude de recherche médicale. Mais qui détermine les exigences ? Et parmi le personnel du fabricant, qui en est responsable ? Voici les principaux acteurs impliqués dans le consentement éclairé pour la recherche médicale commerciale.
1. La Food and Drug Administration (FDA)
La FDA réglemente les dispositifs médicaux et – comme son nom l’indique – les sociétés pharmaceutiques aux États-Unis. Elle requiert le consentement éclairé pour tous les sujets de toutes les études conduisant à l’approbation d’un produit.
Puisqu’une agence de réglementation fédérale l’applique, l’exigence de consentement éclairé de la FDA est inscrite dans la loi – le Code of Federal Regulations, titre 21, volume 1, partie 50, sous-partie B, section 50.20, pour être exact.
2. La Commission d’examen institutionnel (CISR)
La FDA demande aux chercheurs de travailler avec un groupe qui examine les protocoles de recherche – et les documents de consentement éclairé – pour s’assurer que les chercheurs traitent correctement les sujets. Cette organisation s’appelle une CISR (IRB aux Etats-Unis).
Certaines institutions, comme les universités, exploitent leurs propres CISR. Cependant, de nombreux fabricants de dispositifs médicaux passent des contrats avec une CISR ou un IRB local ou régional pour se conformer aux exigences réglementaires de la FDA. Dans tous les cas, l’Office for Human Research Protections (OHRP) du ministère américain de la Santé et des Services sociaux (HHS) doit autoriser l’IRB.
Cela signifie que l’autorité ultime contrôlant les exigences en matière de consentement éclairé dans la recherche médicale est le HHS, du moins aux États-Unis. La FDA est une agence au sein du HHS, et HHS autorise les IRB à tous les niveaux. C’est un peu un système de poupée russe, et les chercheurs doivent transmettre leur documentation de consentement éclairé aux moins à leur IRB et la FDA.
3. Le personnel des affaires réglementaires
La FDA et l’IRB s’assurent que les chercheurs respectent les règles. Les spécialistes des affaires réglementaires sont de l’autre côté de la transaction, employés par le fabricant qui souhaite commercialiser un nouveau produit médical. C’est le travail du personnel des affaires réglementaires de travailler avec l’IRB pour répondre aux exigences de la FDA, y compris celles entourant le consentement éclairé.
Marie Buharin est experte en affaires réglementaires dans le domaine des dispositifs médicaux et fondatrice du site Modernesse. Elle a travaillé dans les services des affaires réglementaires pendant une décennie. “Les affaires réglementaires représentent une position ou une fonction spécifique dans les dispositifs médicaux, les produits pharmaceutiques et les produits biologiques”, explique Buharin. “Nous obtenons l’approbation de la FDA pour ces thérapies.”
4. Les organismes de recherche clinique (ORC)
Le “C” dans “ORC” ne signifie pas seulement “clinique”, au sens “impliquant une observation directe du patient”. Cela réfère également à “contrat”, comme dans un accord commercial. D’ailleurs l’industrie des dispositifs médicaux accepte les deux termes. Les ORC sont des entreprises qui conçoivent et exécutent des études médicales pour les fabricants.
Un fabricant de dispositifs ou une société pharmaceutique embauchera un ORC pour mener les études dont il a besoin pour obtenir l’approbation de la FDA pour un produit. Pendant ce temps, le personnel des affaires réglementaires s’assure que tout le monde se conforme aux réglementations de la FDA tout en travaillant directement avec la FDA et les IRB pour garder la documentation légale propre. Tenir à jour les formulaires de consentement éclairé est une grande partie du travail à réaliser tout au long du processus de recherche.
5. Le chercheur principal
Chaque investigation clinique a besoin d’un leader, quelqu’un qui interagit directement avec les sujets. C’est le chercheur principal, “généralement un médecin spécialisé dans le sujet de recherche, selon la nature de la thérapie”, explique Buharin. Ces médecins intègrent les protocoles de recherche de l’ORC dans le contexte clinique et sont le principal point de contact du patient pour des discussions sur le consentement éclairé.
“Le bureau de l’enquêteur principal est chargé d’obtenir physiquement une signature sur le formulaire de consentement éclairé ainsi que de donner verbalement les informations pour s’assurer que les sujets comprennent ce qu’ils signent”, dit Buharin.
6. Les sujets
Le but du consentement éclairé est de préserver le droit du sujet à prendre une décision en toute connaissance de cause. Le sujet humain d’une étude médicale est la personne la plus importante dans le processus de consentement éclairé. En fait, les promoteurs de l’étude ont un intérêt profond et direct à s’assurer qu’ils informent le plus possible le sujet au cours du processus de consentement.
“Les fabricants se soucient de la sécurité des patients et veulent s’assurer que ces derniers comprennent les risques et les avantages potentiels de l’essai clinique”, déclare Buharin. “Et d’un point de vue réglementaire, si vous n’obtenez pas le consentement éclairé du sujet, vous ne pouvez pas utiliser les informations de ce sujet pour votre investigation clinique.”
Cette perte de données peut couler un brevet. «Dans les dispositifs médicaux, les études sont plus petites que dans les produits pharmaceutiques», dit Buharin. Vous menez des études sur 200, 300, 400 patients. Si vous ne parvenez pas à obtenir le consentement éclairé de 20 d’entre eux, tout d’un coup, vous n’avez que 380 sujets pour montrer à la FDA qu’il s’agit d’une thérapie sûre et efficace, et ils vont dire : “Qu’est-il arrivé aux 20 autres ?”
Si vous n’avez pas de consentement éclairé, vous n’avez pas de données.
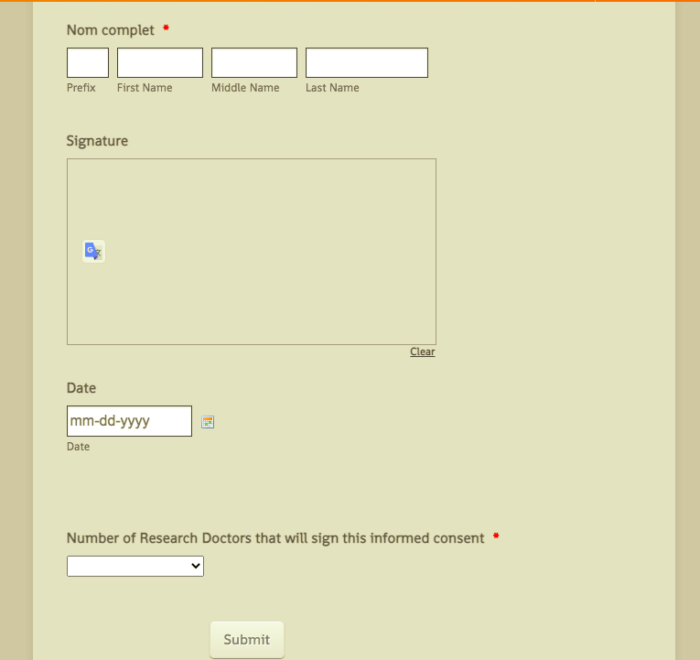
Éléments d’un formulaire de consentement éclairé pour la recherche sur les dispositifs médicaux
Un document de consentement éclairé pour une étude de recherche n’est pas qu’un simple questionnaire. C’est un document juridique qui n’est pas simple. “C’est un document assez long, c’est pourquoi la partie verbale du consentement éclairé est également importante, car les gens ne vont pas rester assis à lire de longs documents juridiques”, explique Buharin. “Nous parlons de la santé des gens, il vous faut donc vraiment vous assurer qu’ils comprennent ce que vous leur expliquez.”
Voici quelques-uns des principaux éléments d’un formulaire de consentement éclairé approprié pour la recherche sur les dispositifs médicaux :
- Une explication de l’objectif et de la méthode de recherche.
- Une liste de risques. “Vous devez indiquer très clairement que le traitement médical qu’ils reçoivent n’est pas standard”, dit Buharin. “Ce traitement fait l’objet d’une étude et il existe des risques qui sont connus, mais aussi de potentiels risques inconnus.” Les chercheurs doivent impérativement communiquer sur ce sujet.
- Une liste de bénéfices. Le produit médical n’a atteint le stade de l’essai que parce que ses fabricants pensent qu’il peut aider les gens ; les avantages potentiels à utiliser le matériel doivent être clairement listés.
- Droits et accords de confidentialité.
- Informations sur la compensation – quel est son montant et quand les sujets la recevront.
- Une liste de contacts pouvant répondre aux questions sur l’étude. “Les sujets ont besoin de pouvoir contacter le chercheur principal, qui est le médecin”, dit Buharin. “Ils auront également besoin d’un contact chez le fabricant, qui est le commanditaire de l’investigation clinique ainsi que potentiellement au sein de l’ORC.”
- Un encart indiquant que la participation est volontaire et peut prendre fin à tout moment.
Ce n’est pas une liste exhaustive. Pour plus d’informations sur ce qu’il faut inclure sur un formulaire de consentement éclairé pour une étude clinique, consultez cette ressource de la FDA. Pour des exemples de formulaires, consultez le modèle de consentement éclairé de Jotform destiné à la recherche .
Ce que le personnel médical doit savoir sur le consentement éclairé pour la recherche sur les dispositifs médicaux
N’importe qui dans le bureau du chercheur principal peut se retrouver avec la tâche de collecter des formulaires de consentement éclairé pour une étude de recherche médicale – ou du moins d’assurer le traitement des données. Les administrateurs, assistants, infirmières et autres médecins peuvent tous participer au consentement éclairé. C’est un travail sérieux, comme le souligne Buharin.
“Ce sont des documents réglementés. Il est vraiment important de prendre le temps de comprendre les informations qu’ils contiennent”, dit-elle. “Posez des questions, et assurez-vous de bien comprendre les informations avant de commencer à en parler aux sujets.”
Selon Buharin, “Un grand nombre de ces formulaires de consentement éclairé sont destinés à des thérapies dont vous n’avez probablement jamais entendu parler. Ce sont des traitements complètement nouveaux. Et il est compliqué d’en comprendre tous les tenants et les aboutissants en langage juridique. N’hésitez pas à demander de l’aide. “
Documenter le consentement est vital, mais le consentement éclairé dans la recherche doit être, avant tout, une conversation et un échange avec le patient.








Envoyer un commentaire: